Kısmi Basınç ve Buhar Basıncı Arasındaki Fark
Kısmi basınç ve buhar basıncı yaygın olarak kullanılır sistem bileşenleri tarafından uygulanan basınç miktarı ile ilgili bilimsel terimler, ancak kimlikleri başkaları için kafa karıştırıcı olabilir. Etkileri ve kimlikleri de dahil olmak üzere bu terimler arasında açık bir ayrım vardır. Bu makale, bu terimlerin arasındaki farklar hakkında daha fazla ayrıntı verecektir. Ayrıca, başvurularını gözden uzaklaştırmak için bazı örnekler de içerecektir.
Buhar ve kısmi basınç arasındaki ayrımı araştırmadan önce basınç kavramını vurgulayarak başlayalım. Basınç, bir cisim veya bir madde üzerindeki birim alan başına uygulanan kuvvet olarak bilimsel olarak tanımlanır. Ayrıca çarpışan parçacıkların birbirlerine uyguladığı kuvvet olarak da tanımlanabilir ve genellikle Pascal kullanılarak ölçülür. Parçacıkların çarpışması durumunda, gaz denklemi ve gazların kinetik teorisi basınç hesaplamak için kullanılır.
Buhar basıncı nedir?
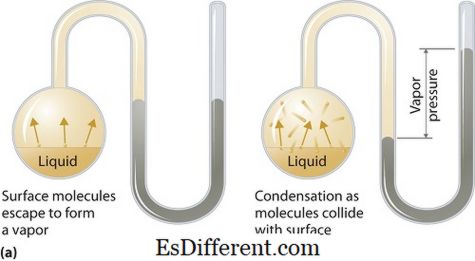
Buhar basıncı sıvı veya katı fazlara uygulanabilir. Hem buhar hem de sıvı (katı) temas halindeyken kapalı bir sistemdeki belirli bir sıcaklıkta buharın termodinamik dengesinde sıvı veya katı halde uyguladığı basınçtır. Bu basınç, katı veya sıvı üzerinde artan bir ısı ile sağlanan buharlaşmanın bir sonucu olarak ortaya çıkar. Böylece sıcaklık, buharlaşma ölçüsü olarak kullanılır ve buhar basıncı ile doğru orantılıdır. Bu, sıcaklığın ne kadar yüksek olursa o kadar yüksek buhar basıncı olduğu anlamına gelir.
Buharlaşma esnasında, hava molekülleri, kapalı bir sistemdeki yüksek kinetik enerjinin sonucu olarak havaya kaçarlar. Daha sonra dengede olduğu zaman, buhar ve yoğunlaşmış sıvı hali (katı) arasında buhar basıncı oluşur. Moleküller arası kuvvetlerin zayıf olduğu çözümlerde buhar basıncı daha fazla olma eğilimindedir ve tersine, moleküllerarası kuvvetlerin daha güçlü olduğu çözümlerde buhar basıncı daha az olur.
Buhar basıncı Raoult Yasası ile açıklandığı üzere ideal karışımlarda da oluşabilir. Bir sıvı veya katı karışım içindeki belirli bir bileşenin kısmi buhar basıncının söz konusu bileşenin buhar basıncına, söz konusu karışımdaki belirli bir sıcaklıktaki mol fraksiyonuna eşit olduğuna işaret eder. Aşağıdaki örnek, bunu gösterecektir. Örnek 1 0. 5 mol. etanol ve 1.5 mol. metanol, sırasıyla 30KPa ve 52KPa buhar basıncıyla, her bileşenin kısmi buhar basıncını belirler.
Çözüm:
Toplam mol sayısı 1. 5mol + 0.5mol = 2.0mol. Raoult Kanununa göre kısmi buhar basıncı, bu bileşenin molar fraksiyonuyla çarpılan buhar basıncına eşittir.Bu durumda, P
metanol
= 1.5/2 * 52 = 39KPa ve P etanol = 0.5/2 * 30 = 7.5KPa. Karışımdaki bileşenlerin kısmi buhar basıncına sahip olduğunuzda, toplam buhar basıncını bir araya getirerek elde edebilirsiniz. Bu bağlamda, 7.5 + 39, etanol ve metanol solüsyonlarının karışımında 46.5KPa toplam buhar basıncı verir. Buhar basıncını etkileyen faktörler
Molekül kimliği
Yukarıda belirtildiği gibi moleküler kuvvet türleri, uygulanacak buhar basıncının miktarını belirler. Kuvvetler daha güçlü olursa, daha az buhar basıncı ortaya çıkar ve zayıflarsa daha fazla buhar basıncı oluşur. Bu nedenle sıvı veya katı bileşimi buhar basıncını etkiler.
Sıcaklık
Yüksek sıcaklık, moleküllerin sıvı yüzeyinden hızlı bir şekilde kaçabilmesi için molekül kuvvetlerini kırmak için daha fazla kinetik enerji harekete geçirdiği için buhar basıncının yükselmesine neden olur. Buhar basıncı (doymuş buhar basıncı) dış basınca (atmosfer basıncı) eşit olduğunda, sıvı kaynamaya başlar. Düşük buhar basıncıyla daha düşük bir sıcaklık ortaya çıkar ve sıvının kaynaması için zaman alacaktır.
Dalton'un Kısmi Basınç Yasası
Kısmi basınç nedir?

Kısmi basınç fikri, ünlü bilim adamı John Dalton tarafından ilk kez önerildi. İdeal bir gaz karışımı tarafından uygulanan toplam basıncın, ayrı gazların kısmi basınçlarının toplamına eşit olduğuna işaret eden Kısmi Basınç Yasasını doğurmuştur. Belirli bir kabın Hidrojen, Azot ve Oksijen gazı ile doldurulduğunu varsayın, toplam basınç, P
TOTAL,
oksijen, azot ve hidrojenin toplamına eşit olacaktır. Bu karışımdaki herhangi bir gazın kısmi basıncı, toplam basıncın bireysel gazın molar kesiriyle çarpımı ile hesaplanır. Özet olarak, kısmi basınç, karışımı belirli bir gazın sistemde yalnız başına oynuyor gibi uyguladığı basınçtır. Böylece, ayrı bir gazın kısmi basıncını belirlerken diğer gazları yok sayarsınız. Bu teori, 0,06atm O 2
'ı 10 0 L'lik bir kutuya 230 K'lık enjekte ederek ve daha sonra 0. 4atm N 2 ' yı aynı bir kutuya enjekte ederek doğrulayabilir aynı sıcaklıktaki aynı büyüklükteki gazları birleştirin ve sonuçta toplam basıncı ölçmek için gazları birleştirin; iki gazın toplamı olacak. Bu, reaksiyona girmeyen gazların karışımında tek bir gazın kısmi basıncını açıkça gösterir. Kısmi basıncın hesaplanması Kısmi basıncın hesaplanması mutlak bir esinti çünkü Dalton yasası [1] bunun için hükümler sunar. Sağlanan tipik bilgiye bağlı olacaktır. Örneğin, A ve B gazının bir karışımı ve A gazının basıncı için toplam basınç verilirse, B'nin kısmi basıncı P
TOTAL
= P kullanılarak hesaplanabilir. A + P B . Gerisi cebirsel işlemlerdir. Fakat sadece karışımın toplam basıncının verildiği bir durumda kısmi basıncı belirlemek için B gazının molar fraksiyonunu kullanabilirsiniz.X ile gösterilen molar fraksiyon, gaz B'nin mollerinin gaz karışımının toplam mollarına bölünmesiyle bulunabilir. Daha sonra kısmi basıncı bulmak için molar fraksiyonu, X toplam basınca çarparsınız. Aşağıdaki örnek, bunu ayrıntılı bir şekilde anlatmaktadır. Örnek 2. sırasıyla 2. 5 mol ve 1.85 mol ile bir Azot ve Oksijen karışımı, toplam 4atm basınç ile 20.0L'lik bir kap içine enjekte edilir; Oksijen gazı tarafından uygulanan kısmi basıncı hesaplar. Çözüm: Karışımdaki toplam mol sayısı 2. 5 + 1.85 = 4.35 mol'dur. Oksijen, X
o
molar fraksiyonu, 1,85 mol / 4 olacaktır. 35 mol = 0.425 mol. Oksijen kısmi basıncı 0.425 x 4atm = 1.7atm olacaktır. Geri kalan gazın kısmi basıncı, aynı yaklaşımı izleyerek hesaplanabilir veya Oksijen gazı ve kısmi Basınçlar Yasası tarafından Dalton yasası tarafından hazırlanan toplam basıncı kullanarak reaktif olmayan gazların toplam basıncının toplamına eşit olduğu kullanılarak hesaplanabilir kısmi baskılar.
Buhar ve kısmi basınç arasındaki fark
Yukarıdaki açıklamalara göre, buhar basıncı ve kısmi basıncın iki ayrı basınç olduğu açıktır. Buhar basıncı sıvı ve katı fazlar için geçerlidir, kısmi basınç ise gaz fazı için geçerlidir. Buhar basıncı, çözeltiye yeterli ısı ilave edildikten sonra faz geçişinde uygulanır ve böylece moleküllerinin kapalı bir sistemden kaçmasına yol açar. Kısmi basınç ve buhar basıncı arasındaki en büyük fark, kısmi basıncın, karışımdaki tek bir gazın, o sistemde yalnızmış gibi uyguladığı basınç olmasıdır; buhar basıncı, buharın maruz kaldığı basınca atıfta bulunurken sıvı veya katı haldeki yoğunlaşmış haliyle termodinamik denge. Aşağıdaki tablo bu basınçların kısa bir karşılaştırmasını vermektedir. Buhar basıncı
Kısmi Basınç
Sıvı veya katı buharın denge halinde yoğunlaşmış fazında uygulanması
Tekli gazlar tarafından reaktif olmayan bir gaz karışımında uygulanır
| Raoult's tarafından iyi açıklanmıştır Kanun | Dalton Yasası |
| ile iyi açıklanmıştır. Katı ve sıvı fazlarda uygulanabilir | Yalnızca gaz fazlarında uygulanabilir |
| Yüzey alanından veya sistem hacminden bağımsız | Aynı gazlar kullanılarak hesaplanmıştır hacim |
| Çözeltinin mol fraksiyonu kullanılarak hesaplanmıştır | Gazın mol fraksiyonu kullanılarak hesaplanmıştır |
| Sarıl! | Buhar basıncı ve kısmi basınç, belirli sıcaklıklarda verilen kapalı sistemde sırasıyla gaz ve buharların uyguladığı kuvvetlerin etkilerini belirlemek için kullanılan iki önemli bilimsel terimdir. Başlıca farkı, sıvı veya katı fazlara uygulanan buhar basıncı ile uygulama alanıdır; kısmi basınç, belirli bir hacimde ideal gaz karışımında tek bir gaz üzerine uygulanır. |
| Kısmi basınç Dalton'un Kısmi Basınç Yasası uyarınca kolayca hesaplanırken, buhar basıncı Raoult Kanunu uygulanarak hesaplanır.Herhangi bir karışımda, her gaz bileşeni, diğer gazlardan bağımsız olarak kısmi basınç olarak adlandırılan kendi basıncını uygular. Ve herhangi bir bileşenin molünü sabit tuttuğunuzda kısmi basıncı artıracağınız anlamına gelir. Clausius-Clapeyron ilişkisine [2] göre sıcaklık arttıkça buhar basıncı artar. | Yukarıdaki bilgilerle buhar basıncı ve kısmi basıncı birbirinden ayırt edebilmelisiniz. Molar kesirler kullanarak hesaplayabilmeniz ve toplam basıncın çarpımı yapmanız gerekir. Bu baskıların uygulanması hakkında ayrıntılı bilgi vermek için tipik örnekler verdik. |




