Asit-Baz Titrasyonu ve Redoks Titrasyonu Arasındaki Fark | Asit-Baz Titrasyonu vs Redoks Titrasyonu
Anahtar Difference - Asit-Baz Titrasyonu ve Redoks Titrasyonu
Titrasyonlar, bilinmeyen bir çözeltinin (analitin) konsantrasyonunu belirlemek için kullanılır. En çok kullanılan iki titrimetrik yöntem asit-baz titrasyonları ve redoks titrasyonlarıdır. Asit-baz titrasyonları ve redoks titrasyonları arasındaki anahtar fark, titrasyonda titrant ve analit arasında gerçekleşen reaksiyonun niteliğidir (999). Asit-bazlı titrasyonlarda, nötrleştirme reaksiyonu gerçekleşir ve redoks titrasyonlarında bir redoks reaksiyonu oluşur (oksitleyici reaksiyon ve indirgeme reaksiyonu). Göstergelerin kullanılması, reaksiyonun bitiş noktasını belirlemede en yaygın kullanılan yöntemdir. Asit-Baz Titrasyonu Nedir?
Asit-bazlı titrasyonlarda, titrant olarak bir asit (asidik titrasyonlar) veya bir baz (baz titrasyonları) kullanılır. Asitli titrasyonlarda kullanılan asit örnekleri, HCI veya HNO3'tür.
Çoğunlukla kullanılan bazik titratlar NaOH, K CO 3 veya Na 2 CO 3'tür. Asit-baz titrasyonları asit ve bazın dayanımına bağlı olarak aşağıdaki gibi sınıflandırılabilir.
- Bir redoks titrasyonu bir redoks reaksiyonunu içerir. Redoks reaksiyonunun iki reaksiyonu vardır; bir oksidasyon reaksiyonu ve bir indirgeme reaksiyonu. Hem oksidasyon hem de indirgeme işlemleri, reaksiyonun tamamlanmasını belirlememizi sağlayan aynı zamanda gerçekleşir. Bu aynı zamanda titrasyonun son noktası olarak da bilinir. Bu, çeşitli şekillerde belirlenebilir; indikatör elektrotları, redoks göstergeleri (indikatör, oksidasyon-redüksiyon durumunda farklı bir renk üretir) ve redoks içermeyen göstergeler (aşırı miktarda titrant eklendiğinde gösterge bir renk üretir) kullanıyor.
- Asit-Baz Titrasyonu ve Redoks Titrasyonu arasındaki fark nedir?
- Reaksiyonun doğası:
- Asit-Baz Titrasyonu:
Bir asit-baz titrasyonu, analit (bilinmeyen konsantrasyonu olan solüsyon) ile asit veya baz titrant arasındaki nötrleştirme reaksiyonunu içerir.
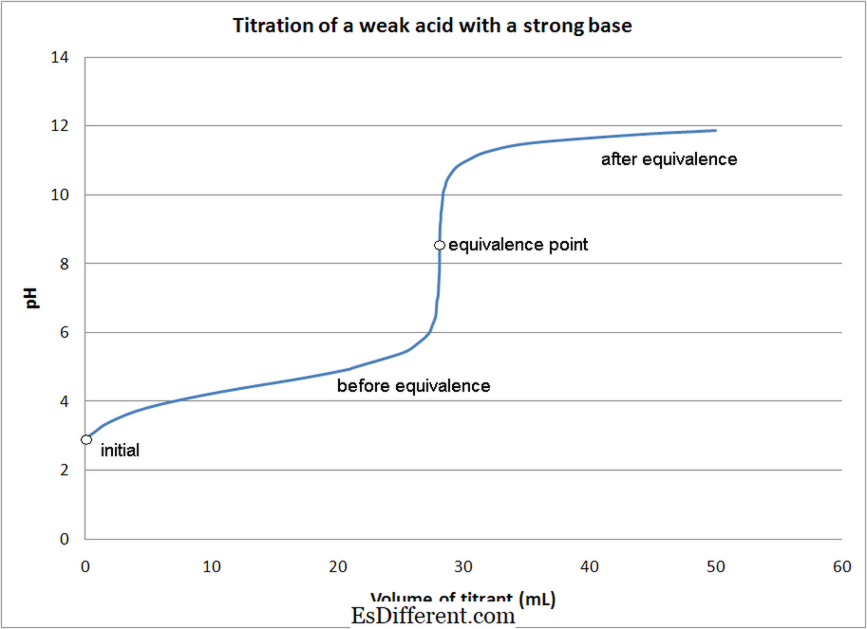
Redoks reaksiyonu analit ve titrant arasındaki oksidasyon ve indirgeme reaksiyonunu içerir. Bileşenin oksitlenmesi ve birinin indirgediği böyle bir kural yoktur. Analit veya titrant oksitlenir ve geri kalan bileşen buna göre azalır.
Bitiş noktasının belirlenmesi:

Asit-Baz Titrasyonu:
Genel olarak, asit-baz titrasyonunun bitiş noktasını belirlemek için bir pH göstergesi, bir pH metre veya bir iletkenlik ölçer kullanılır.
Redoks Titrasyonu: Redoks reaksiyonunun son noktasını belirlemede en yaygın kullanılan yöntemler bir potansiyometre veya bir redoks göstergesi kullanıyor. Ancak, çoğu zaman analit veya titrant uç noktada bir renk üretir. Dolayısıyla, bu durumlarda ilave göstergeler gerekli değildir.
Örnekler: Asit-Baz Titrasyonu:
- diff Makale Tablo ->
Tip Reaksiyon (Gösterge)
Kuvvetli asit - güçlü baz titrasyonu HCl + NaOH → NaCl + H
2
O (Fenolftalein / Metil turuncu)
Kuvvetli asit - zayıf baz titrasyonu| Zayıf asit - güçlü baz titrasyonu | |
| HCI + NH | 3 CH 3 COOH + NaOH CH |
| CO9 + H | 2 O (Fenolftalein) Zayıf asitle zayıf baz titrasyonu CH 3 |
| C99H + 3 | àCH 3 COO - + NH 4 + |
| (Uygun göstergeler yok) | Redoks Titrasyonu: 4 6 HC1 → 2 MnCl 2 + 2KCl + 10CO 2 + 8H (+ 7) (+3) (+2) 4) Yukarıdaki reaksiyonda permanganat indirgenirken, oksalik asit okside olur. Reaksiyon tamamlandığında permanganatın mor rengi renksizleşir. + + 9Cl> + 9HCl 5FeCl |
3
+ MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2) Resim Nezaket: 1. Zayıf asidin kuvvetli baz ile titrasyonu Kuantumkinetik ile (Kendi çalışma) [CC BY 3. 0], Wikimedia Commons yoluyla. Willwood tarafından "Winkler Titrasyonu Önceki Titrasyonu" [CC BY-SA 3. 0] Commons aracılığıyla




