Alkanlar ve Alken Arasındaki Fark | Alkanes vs Alkene
Anahtar Diferansiyel - Alkanlar ve Alkenler
Alkanlar ve Alkenler molekül yapısında karbon ve hidrojen içeren iki hidrokarbon ailesi türüdür. Alkanes ve Alkenler arasındaki en önemli fark kimyasal yapılarıdır; alkanlar genel moleküler formül C n H 2n + 2 olan doymuş hidrokarbonlardır ve alkenlerin doymamış bir hidrokarbon grubu olduğu söylenir, çünkü bunlar iki karbon atomu içerir. Bunlar, C n H 2n genel molekül formülüne sahiptir.
Alkanlar Nedir?
Alkanlar, Karbon ve hidrojen atomları (C-C bağları ve C-H bağları) arasında yalnızca tek bağ içerir. Bu nedenle buna "doymuş hidrokarbonlar" denir. Orbital hibridizasyon modeline göre, Alken'lerdeki tüm karbon atomları SP 3 hibridizasyona sahiptir. Hidrojen atomlarıyla sigma bağları oluştururlar ve ortaya çıkan molekül tetrafehedron geometrisine sahiptir. Alkanlar, moleküler düzenlemelerine göre iki gruba ayrılabilir; asiklik alkanlar (C n H 2n + 2 ) ve siklik alkanlar (C n H 2n ).

Alkenler Nedir?
Alkenler, bir Karbon Karbon (C = C) çift bağ içeren hidrokarbonlardır. "Olefin", alken ailesine atıfta kullanılan eski addır. Bu ailenin en küçük üyesi etandır (C 2 H 4 ); ilk günlerde olefiyen t gazı (Latince'de ' oleum' 'yağ' + 'facere' anlamına gelir "denir) adı verildi. Bunun nedeni, C 2 H 4 ve Klor arasındaki reaksiyonun C 2 2 C 2 sıvı yağ.

n
H
2n + 2'ye sahiptir. Metan (CH 4 ) en küçük alkandır. - diff Makale Tablo ortasından önce ortadan -> Ad Kimyasal formül Asiklik yapı
Metan| 4 | 4 | |
| Etan C 2 | , H 6 | |
| CH | 3 CH 3 Propan | C 3 , H 8 |
| CH | 3 CH 2 CH | 3 Bütan C 4 , H 10 |
| CH 3 | CH 2 CH 2 | CH 3 Pentan C 5 , H 12 CH |
| 3 | CH 2 CH 2 | CH 2 CH 3 Heksan C 6 'H 14 CH 3 |
| CH | 2 CH 2 CH | 2 CH 2 CH 3 Heptan C 7 , H 16 CH 3 |
| CH | 2 CH 2 CH 2 | CH 2 CH 2 CH 3 oktan C 8 , H 18 CH 3 CH |
| 3 | CH 2 CH 2 | CH 2 CH 2 CH 3 CH 3 Alkenler: Alkenlerin genel kimyasal formülü C n H 2n 'ya sahiptir.Alkenler, bir hidrokarbon molekülünün sahip olabileceği azami hidrojen atomu içermediğinden, doymamış hidrokarbonlar olarak düşünülür. Ad Kimyasal formül Yapı Etilen |
2 H 4 CH 2 = CH
| 2 | Buten | C |
| 4 | 2 2 Buten C | 4 CH CH = CHCH, CH = CHR999, CH = CHR999, CH = CHCH, > 3 penten C |
| 5 | , H 10 CH 2 = | CHCH 2 CH 2 |
| Heksen | 6 H Heksen H | H H > 12 CH 2 = CHCH 2 CH 2 CH |
| 2 | CH 3 CH 3. | CH = CHCH 2 CH 2 CH 3 CH 3 CH 2 CH = CHCH 2 |
| CH | 3 hepten C 7 | , H 14 CH = CHCH < 2 CH 2 CH 2 CH 2 CH 3 CH 3 CH = CH < 2 CH 2
CH 2 CH 2 CH 3 Alkanların ve Alkenlerin Kimyasal Özellikleri Alkanes: Reaktivite: Alkanlar birçok kimyasal reaktif için etkisizdir. Çünkü Karbon ve Hidrojen atomlarının neredeyse aynı elektronegatiflik değerlerine sahip oldukları için Karbon Karbon (C-C) ve Karbon - Hidrojen (C-H) bağları oldukça güçlüdür. Bu nedenle, oldukça yüksek sıcaklıklara ısıtılmadıkça bağlarını kırmak çok zordur. |
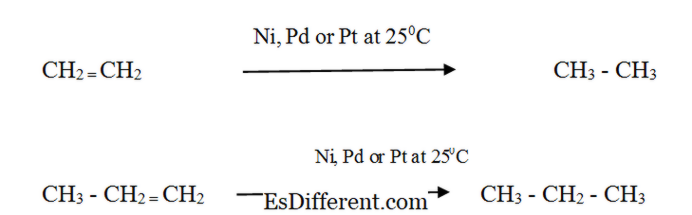
| Yakma: | Alkanes havada kolayca yanabilir. Fazla Oksijene sahip Alkanlar arasındaki reaksiyon "yanma" olarak adlandırılır. Bu reaksiyonda alkanlar Karbon dioksit (CO 2 ) ve suya dönüşürler. n | n n n H 2n + (n + n / 2) 0 2 n CO 2 + nH 2 → 4 CO 2 + 5H (2999) + > 2 O Bütan Oksijen Karbon Dioksit Suyu Yanma reaksiyonları ekzotermik reaksiyonlardır (ısı verirler). Sonuç olarak, alkanlar bir enerji kaynağı olarak kullanılır. Alkenler: Reaktivite: Alkenler, karşılık gelen alkan oluşturmak üzere ince bölünmüş bir metal katalist varlığında hidrojen ile reaksiyona girer. Reaksiyon hızı, bir katalizör olmadan çok düşüktür. Katalitik hidrojenasyon, margarin ve katı yemeklik yağ üretirken sıvı bitkisel yağları yarı katı yağa dönüştürmek için gıda endüstrisinde kullanılır. Alkanlar ve Alkenlerin Fiziksel Özellikleri Formlar |
Alkanlar:
Alkanes gazlar, sıvılar ve katı maddeler olarak bulunur. Metan, etan, propan ve bütan, oda sıcaklığında gazlardır. Dağılmamış heksan, pentan ve heptan yapıları sıvı haldedir. Daha yüksek bir molekül ağırlığına sahip olan alkanlar katılardır. C 5
H
12
ila
17 H 36
sıvı haldedir ve daha yüksek molekül ağırlıklı Alkanes yumuşak katıdır Alkenler: Alkenler, ilgili Alkanın benzer fiziksel özelliklerini gösterir. Daha düşük molekül ağırlığına sahip olan (C 2 H C H 8) alkenler, oda sıcaklığında ve atmosferik basınçta gazlardır.Daha yüksek bir moleküler ağırlığa sahip olan alkenler katılardır. Çözünürlülük: Alkanlar: Alkanes suda çözünmez. Kutupsuz veya zayıf polar organik çözücüler içerisinde çözülürler. Alkenler: Alkenler C = C bağından dolayı nispeten polar moleküllerdir; Bu nedenle, polar olmayan çözücüler veya düşük polariteli çözücüler içinde çözünürler. Su polar molekül ve alkenler suda az çözünür. Yoğunluk: Alkanlar: Alkanes yoğunluğu suyun yoğunluğundan daha düşüktür. Suyun yoğunluğu 1.0 g mL -1 olarak kabul edildiğinde, yoğunluğu yaklaşık 0,7 g mL
-1
civarındadır.
Alkenler:
Alkenlerin yoğunlukları suyun yoğunluğundan daha düşüktür.
Kaynama noktaları:
Alkanlar:
Kararsız atomların sayısı ve moleküler ağırlık arttıkça dağılmamış alkanların kaynama noktası artar. Genel olarak, dallı alkanlar, aynı sayıda Karbon atomuna sahip olan dallanmamış alkanlara kıyasla daha düşük kaynama noktalarına sahiptir.
Alkenler
: Kaynama noktaları, küçük bir varyasyona sahip olan alkanlara benzer. Kaynaklar:
CliffsNotes. (n.d.). 06.06.2010, buradan alınmıştır. Alkanların Fiziksel Özellikleri. (2013). 06.06.2010, Buradan Zum Dizini-modülü alındı. (n.d.). 06 Haziran 2016, buradan itibaren Alkanes'in kimyasal özellikleri: Wizznotes. ücretsiz GCSE ve CXC: Dersler, Geçmiş Makaleler ve Sınavlar. (n.d.). 06 Temmuz 2016, burada buradan Polarite alındı. (n.d.). 06.06.2010, Buradan Dipole anları alındı. (2013). 06.06.2010, buradan itibaren Yapısal izomer elde edildi. (n.d.). 06 Haziran 2016, buradan itibaren alındı
Alkenlere giriş. (n.d.). "Resimlerin izniyle:" "Alkene isimleri" - Chris Evans - (CC0) Commons Wikimedia aracılığıyla "Saturated C4 hydrocarbons ball-and-stick" Fvasconcellos tarafından - Kendi çalışması (Kamu Etki Alanı) Commons Wikimedia aracılığıyla




