Dengeli Eşitlik ve Net İyon Denklem Arasındaki Fark | Dengelenmiş Eşitlik ile Net İyon Denklemi
Anahtar Difference - Dengelenmiş Eşitlik ile Net İyonik Denklem
Tüm kimyasal reaksiyonlar bir denklem olarak yazılabilir. Bu denklemin bileşenleri fiziksel durumlarıyla reaksiyona giren maddeleri, reaksiyon yönünü göstermek için bir ok ve fiziksel durumlarıyla tepkime ürünlerini içerir. Kullanılan özel şartlar olsaydı ok kısaca yazılırlar. Reaksiyon dengedeyken, karşıt yönde iki yarım ok kullanılır. Bir kimyasal denklem iki şekilde yazılabilir: dengeli denklem veya bir net iyonik denklem olarak. Dengeli denklem ve net iyonik denklem arasındaki en önemli fark, dengelenmiş denklemi, bir sistemde oluşan tüm reaksiyonları birlikte gösterirken, net iyonik denklem yalnızca bu özel tamamlandıktan sonra oluşan net reaksiyonu göstermektedir reaksiyon.
İÇİNDEKİLER
1. Genel ve Anahtar Farkı
2. Dengeli Denklem nedir
3. Net İyonik Denklem nedir
4. Yan yana Karşılaştırma - Dengelenmiş Eşitlik ile Net İyonik Denklem
5. Özet
Dengeli Eşitlik Nedir?
Kimyasal reaksiyonlar, belirli bir sistemin davranışını anlamada çok önemlidir. Reaksiyon için doğru denklemi yazarak, o sistemdeki farklı türlerin değişiklikleri hakkında bir fikir edinebilirsiniz. NaCl'nin suda eritilmesi gibi basit reaksiyonlar için, bu reaksiyonun muhtemel ürünlerini tahmin ederek denklem kolayca yazılabilir. Ancak, diğer karmaşık reaksiyonlar için, söz konusu sistemin ürünlerini bulmak için daha ileri testler yapılması gerekebilir. Ancak çoğu zaman, yazılı denklemin dengesiz olması muhtemel ve bu da o sistemin kimyasal davranışını açıklamanın zorluğunu doğuruyor. Bu nedenle dengesiz denklemler de dengelenmelidir. Dengeli denklem, o sistemin tüm reaktanlarını ve ürünlerini içerir. Denklem, reaktan bileşiğini bir molekül olarak düşünerek yazılır. Örneğin, KI ve PbNO 3 arasındaki dengeli denklem (suda tepkimeye girdiyse);

Dengeli bir denklemin önemi, sistemdeki türler arasındaki stokiyometrik ilişkiler hakkında ayrıntılar veren eklenecek reaktiflerin miktarlarını ortaya koymasıdır. Yukarıdaki örnekte, PbNO 3 ve KI arasındaki oran, bu bileşenleri sisteme eklerken 1: 2 olmalıdır.
Net İyonik Denklem nedir?
Net iyonik denklem, yalnızca sistemde gerçekleşen genel reaksiyonu gösterir. İyonik türleri ve oluşan ürünleri içerir. Fakat belirli bir sistemde meydana gelen tüm reaksiyonları göstermez. Örneğin, ortam olarak su kullanan iki molekül arasında bir reaksiyon varsa, bileşikler su içinde çözülmüş ve iyonlara ayrılmış olabilir. Bu iyonlardan bazıları reaksiyona karışmış olabilir, ancak bazıları bu reaksiyona dahil olmayabilir. Daha sonra net iyonik denklem yalnızca bir net reaksiyona katılan iyonları içerir. İzleyici iyonları adı verilen diğer iyonlar, denklemden çıkarılarak net iyonik denklem elde edilir. Örneğin, KI ve PbNO 3 su içinde reaksiyona girdiğinde, net iyonik reaksiyon olur;
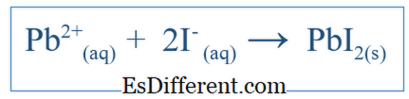
Bu ayrıca K + iyonu ve NO3 - iyonu içermelidir, ancak bu iyonlar yalnızca çözülür ve ana tepkime katılmaz; Dolayısıyla, net iyonik reaksiyona dahil değildirler.
Denklem ve Net İyon Denkliği arasındaki fark nedir?
- diff Makale Tablosunun Ortasından Önce Orta ->
Dengeli Eşitlik ile Net İyon Denklemi |
|
| Kullanılan tüm bileşenler dengelenmiş denklemdeki reaktifler olarak yazılır. | Sadece net reaksiyona giren reaktanlar net ionik reaksiyonda yazılırdı. |
| Ürünler | |
| Reaksiyonun sonunda bulunan tüm bileşenler dengeli bir denklem içine dahil edilir. | Net iyonik bir denklemde, yalnızca net son ürün yazılır. |
| Verilen Bilgiler | |
| Dengeli denklem sistemdeki tüm türler hakkında ayrıntılı bilgi verecektir. | Net iyonik denklem, yalnızca reaksiyonda yer alan türler hakkında bilgi verir |
Özet - Denge Eşitliği ile Net İyonik Denklem
Bazı iyonik bileşikler suya ilave edildiğinde parçalanır ve çözünmüş iyonlar oluştururlar Suda. Bu, anyonlar ve katyonlar üretir. Reaksiyonun tamamlanmasından ve reaksiyon yönünden sonra üretilen türlerin gösterilmesi için bir kimyasal denklem yazılabilir. Bu denklem, okun iki yanında kalan her bir türün atom sayısını dikkate alarak dengelenebilir; Bazen bu türlerin sorumluluğu bile dikkate alınmalıdır. Bu, söz konusu sistem için dengeli bir kimyasal denklem verir. Bununla birlikte, net iyonik denklem yalnızca reaksiyona giren türleri kapsar. Daha önce de belirtildiği gibi dengelenmiş denklem ve net iyonik denklem arasındaki en önemli fark, dengeli denklemin bir sistemdeki tüm reaksiyonları gösterdiğini, buna karşın net iyonik denklemin yalnızca belirli reaksiyonun tamamlanmasından sonra gerçekleşen net reaksiyonu gösterdiğidir.
Kaynaklar:
1. Chang, R., 2010. Kimya. 10. baskı. NewYork: McGraw-Hill.
2. Kimyasal Reaksiyonlar. (n.d.). 26 Mayıs 2017'de // www. Ric. edu / öğretim / ptiskus / reaksiyonlar /
3. Komple iyonik ve net iyonik denklemler. (n.d.). 26 Mayıs 2017, // www. Adresinden alındı. Khan Academy. org / bilim / kimya / kimyasal reaksiyonlar-stoichiome / tipleri-of-kimyasal reaksiyonlar / a / tam-iyonik ve net iyonik denklem.




