Berilyum ve Alüminyum Arasındaki Fark | Berilyum vs Alüminyum
Anahtar Diferansiyel - Berilyum vs Alüminyum Berilyum ve Alüminyum, periyodik tablodaki iki farklı periyot ve grupta iki metalik elementtir: Berilyum ve Alüminyum arasındaki farkı (Atom numarası = 4), Alüminyum ise bir XIII elementi (atom numarası = 13) olan Beryllium moleküleridir. Farklı kimyasal özelliklere sahipler ve kendilerine has özellikler taşımaktadırlar Örneğin, metalik özelliklerini göz önüne alırsak Berilyum, inşaatta kullanılan en hafif metal ve Alüminyum, Demir'den sonra dünyada ikinci büyük metaldir.
Berilyum nedir? ?
Berilyum (Be), bir tomic number 4 ve elektronik konfigürasyon 1s 2 2s 2 'dır. Periyodik tabloda grup II ve dönem 2'de yer almaktadır. Alkali toprak ailesinin en hafif üyesidir. Berilyum doğal olarak Bertrandit (Be 4 2 O 7 (OH) 2 ), Beril (Al < Chrysoberyl (Al 2 BeO 4 2 Be 3 Si 6 18 ) ve Fenakit (Be 2 Sİ 4 ). Dünya yüzeyindeki berilyum miktarı yaklaşık 4-6 ppm'dir, nispeten düşüktür.

2s
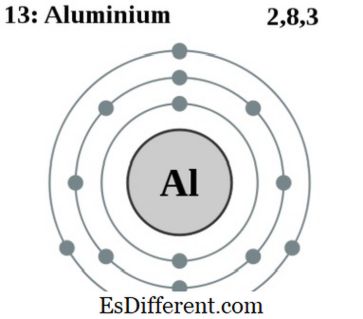
2 2p 6 3s 2 3p 1 . Yalnızca doğal olarak oluşan bir izotop alüminyum-27 vardır. Doğal olarak birçok farklı mineralde ve yerkabuğunda alüminyum bolluğu oluşur. Alüminyum, endüstriyel uygulamalarda çok önemli bir elementtir. Dünyada kullanılan ikinci en büyük metalik elementtir.
Berilyum grimsi beyaz bir yüzeye sahip metalik bir elementtir; kırılgan ve sert (yoğunluk = 1,8 gcm
-3
). İnşaat endüstrisinde kullanılabilecek en hafif metalik elementtir. Erime noktası ve kaynama noktası sırasıyla 1287 ° C (2349 ° F) ve 2500 ° C (4500 ° F) 'dir. Berilyum yüksek bir ısı kapasitesine ve iyi ısı iletkenliğine sahiptir. Berilyum malzemeden yapılan x-ışınlarının penetrasyonuyla ilgili ilginç bir özelliğe sahiptir. X ışınlarına karşı şeffaftır; Başka bir deyişle, x-ışınları Berilyum'u emilmeden geçirebilir. Bu nedenle, bazen röntgen makinelerinde pencereleri yapmak için kullanılır. Alüminyum: Alüminyum, hafif mavimsi renk tonuyla gümüşi metalik bir parlaklığa sahiptir. Hem sünek hem de ince tel yapabilme kabiliyeti ve yumuşaklıktır (kırılma veya çatlama olmaksızın çekiç veya kalıcı olarak şekilden basılma kabiliyeti). Erime noktası 660 ° C (1220 ° F), kaynama noktası 2327-2450 ° C (4221-4442 ° F). Alüminyum yoğunluğu 2.708gcm
-3
'dır. Alüminyum son derece iyi bir elektrik iletkeni. Düşük maliyetli bir malzemedir ve mühendisler Alüminyum'u elektrikli cihazlarda daha sık kullanmaya çalışırlar. Kimyasal Özellikler: Berilyum: Berilyum, asit ve su ile reaksiyona girerek hidrojen gazı üretir. Havadaki oksijen ile reaksiyona girer ve yüzey üzerinde koruyucu bir oksit tabakası oluşturur ve metalin daha fazla reaksiyona girmesini önler.
Alüminyum:
Alüminyum yavaş yavaş oksijenle reaksiyona girer ve metal üzerinde çok ince, beyaz bir kaplama oluşturur. Bu oksit tabakası, metalin daha fazla paslanmasını ve paslanmasını önler. Alüminyum oldukça reaktif metaldir; Sıcak asitlerle ve alkalilerle de reaksiyona girer. Bu nedenle Alüminyum amfoterik bir element olarak kabul edilir (hem asit hem de alkalilerle reaksiyona girer). Ayrıca, sıcak suyla çabucak reaksiyona girer ve toz haline getirilmiş Alüminyum şekli alev alevlendiğinde çabucak yanar. Kullanım Alanları:
Berilyum: Berilyum çoğunlukla alaşımlarda kullanılır; en çok bakır ile. Aynı zamanda telekomünikasyon ekipmanları, bilgisayarlar ve cep telefonları üretiminde de kullanılır.
Alüminyum:
Alüminyum, ambalaj malzemeleri, elektrikli teçhizatlar, makineler, otomobiller ve inşaat sektöründe üretilmektedir. Aynı zamanda ambalajda bir folyo olarak da kullanılır; bu eritilebilir, tekrar kullanılabilir veya geri dönüştürülebilir. Resim Nezami:
1. Elektron kabuğu 004 Beryllium - etiket yok Pumbaa'ya göre (Greg Robson'ın orijinal çalışması) (Dosya: Electron
Kabuk 004 Berilyum.vb) [CC BY-SA 2. 0 uk], via Wikimedia Commons
2. Elektron kabuğu 013 Alüminyum Pumbaa türev çalışma: Malzeme Bilimi [CC BY-SA 2. 0 uk], Wikimedia Commons




