Etanol ve Etanoik Asit Arasındaki Fark | Etanol vs Etanoik Asit
etanol ve etanoik asit, etanol ve etanoik asit farkı, etanol vs etanoik asit, Anahtar Farkı - Etanol vs Etanoik Asit
Etanol ve Etanoik asitin benzer isimleri olmasına rağmen, iki farklı fonksiyonel grup içeren iki farklı organik bileşik olduğundan, aralarında önemli bir fark olabilir.
Etanol alkol ailesinin en basit ikinci üyesidir, ise etanoik asit karboksilik asit grubunun ikinci en basit üyesidir. Her ikisi de molekülde bulunan fonksiyonel gruba ek olarak yalnızca iki Karbon atomu içerir. Kimyasal özelliklerini karşılaştırdığımızda; Her ikisi de organik solventler olarak kullanılır ve karakteristik bir kokuya sahiptir. Buna karşılık, etanoik asit etanoldan daha asidiktir.
Neis Etanol ? Etanolün ortak adı etilen alkolü
etilen alkoldür 'dır. Fonksiyonel grubu bir hidroksil grubudur (-OH grubu). Reaktivite, asitlik veya bazlık gibi kimyasal özelliklerin tümü fonksiyonel gruba bağlıdır. Etanol çok hafif bir kokuydu ve uçucu bir bileşiktir. Etanol endüstriyel uygulamalarda çok önemlidir; ilaç ve kozmetik ürünleri üretmek için kullanılan, yakıt kaynağı olan güvenli bir solventtir ve alkollü içeceklerde ana bileşen oluşturmaktadır. Etanol yurtiçinde mısır, şeker kamışı veya çim gibi tarım atıkları kullanılarak üretilebilir.

olduğu Etanoik asit ? Etanoik asit için en çok kullanılan ad
asetik asit 'dır. Karakteristik ekşi tat ve keskin kokusu olan renksiz bir sıvıdır. CH 3 COOH moleküler formüle sahiptir. Seyreltilmemiş etanoik asit formuna "buzul asetik asit" denir ve sirke yapmak için yaklaşık% 3-9 oranında asit kullanılır. Etanoik asit zayıf bir asit olarak kabul edilir; ancak, aşındırıcıdır ve deriye saldırabilir.
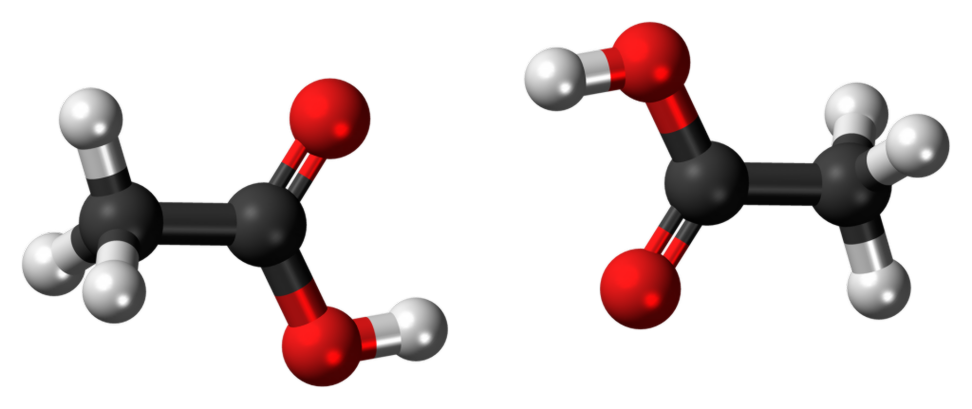
Etanol ve Etanoik Asit Özellikleri:
Fonksiyonel Grup:
Etanol:
Hidroksil grubu (-OH grubu) etanolün fonksiyonel grubudur. Bu, alkollerin karakteristik özelliğidir. Bütün alkollerin yapılarında en az bir -OH grubu bulunur. Etanoik asit:
Etanoik asitteki fonksiyonel grup bir -COOH grubudur. Tüm karboksilik asitler için ortaktır. Özellikleri:
Etanol:
Etanol, 78.5 ° C'de kaynayan tatlı kokusu olan monohidrik bir alkoldür. Suda her oranda çözünen tek hidrokarbon budur.Etanol, etanoik asit vermek üzere alkalin KMnO4 ile reaksiyona girer, etanoik asit ise alkalin KMnO4 ile reaksiyona girmez. Etanoik asit:
Sulu çözeltide zayıf bir monoprotik asittir (pKa = 4.76). Sıvı asetik asit su gibi kutupsal bir solventtir. Şekerler ve tuzlar gibi polar sıvılar ile yağlar ve kükürt ve iyod gibi elementler gibi polar olmayan sıvılar çözülür. Su kloroform ve hekzan ile kolayca ve tamamen karışabilir. Asetik asit kuvvetli bir keskin kokuya sahiptir. Kullanım Alanları:
Etanol:
Etanol, alkollü içeceklerde bulunur ve ayrıca otomobiller için biyoyakıt olarak kullanılır. Suda çözünmeyen birçok organik çözeltiyi çözebilen iyi bir çözücüdür. Etanol boya endüstrisinde birçok parfüm, kozmetik ve vernik üretimi için kullanılır. Yakıt olarak etanol:
2
3 2 2CO 2 + 3H 2 O Etanoik asit: Asetik asit, diğer kimyasalları üretmek için bir kimyasal reaktif olarak kullanılır. Vinil asetat monomerini üretmek için daha büyük miktarlarda kullanılır; vinil asetat, polivinil klorür veya diğer polimerler üretmek üzere polimerleştirilebilir. Buna ek olarak, asetik asit, mürekkep, boya ve kaplamalarda kullanılan esterleri üretmek için kullanılır. Asetik anhidrit, iki asetik asit molekülünü yoğunlaştırarak sentezlenebilen önemli bir kimyasal bileşiktir. Evde kullanılan sirke üretmek için az miktarda etanoik asit kullanılır. Asitlik: Etanol:
Etanol, Sodyum bikarbonat (NaHCO₃) ile reaksiyona girmez veya mavi litmus kağıdının rengini değiştirmez. Bu nedenle, etanoik asitten daha az asidiktir. Etanoik asit:
Etanoik asit, CO2 gazı serbest bırakan sodyum bikarbonat (NaHCO₃) ile reaksiyona giren zayıf bir asittir. Ayrıca, mavi litmusu kırmızıya çevirir.
Görüntü Nezaketinde: "Etanol-3D-toplar". (Public Domain) aracılığıyla Wikimedia Commons'da "Asetik asit dimer 3D ball" yazan Jynto (mesaj) - Kendi çalışması. (CC0) aracılığıyla Wikimedia Commons'ı indirin


