Monatomik ve Diatomik Arasındaki Fark | Monatomik ve Diatomik
Monatomik ve diatomik arasındaki fark esas olarak türe ait atomlarla ilişkilidir. Adlardan da anlaşılacağı üzere, bu iki terim, 'mono' terimi 'bir' ve 'di' terimi 'ikili' anlamına gelen farklı atom dernekleri devletlerini simgelemektedir. 'Bu nedenle basitçe, monatomik bir'
bir atom 've diatomik' iki atom anlamına gelir. ' Bununla birlikte, bu temel tanıma pek çok farklı varyasyon olabilir.
Monatomik Nedir?tek bir atom kendi başına (nadiren durum) mevcut olduğunda, bunu monatomik olarak adlandırırız. Bu, elementlerin saf tekil formda olduğu anlamına gelir. Bu kategoriye giren tek pratik örnek, dış kabukları bir sekizli elektron ile tamamlandığı için kendi başına atom olarak var olan asal gazlardır. Dolayısıyla daha istikrarlı olabilmek için daha fazla elektron kabul veya bağışta bulunmaya bakmazlar. Bu nedenle soygazlar monatomik formda kararlıdır. Bazı örnekler; He - Helyum, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Kripton, Rn - Radon.
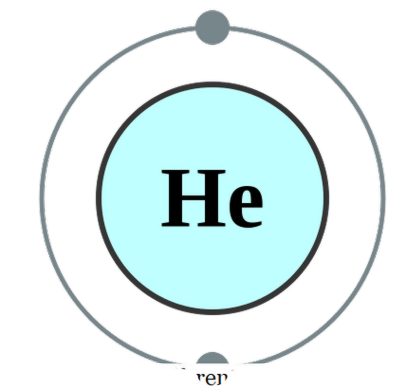
Diatomik Nedir?
iki atom birbiriyle ilişkili olduğunda, bunu iki atomlu olarak adlandırırız. Bu atomlar aynı türden veya farklı olabilir. Birlikte iki benzer atom olduklarında ' homonükleer diatoms ' diyoruz ve farklı tiplerden yapılmışlarsa buna " heteronükleer diatoms " diyoruz. Bazı homonükleer diatomlar için örnekler O2, N2, H2, vs. olacaktır, oysa CO, NO, HCl, vb. Heteronükleer diatomlar için örnek olarak verilebilir. Oksijen
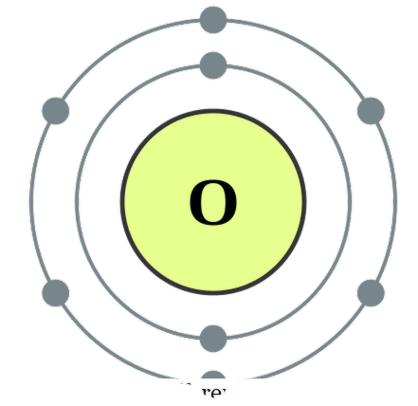
Diatomlar, elektronları birbirleriyle paylaşarak daha istikrar kazanmak için bu birleşmeleri oluşturan bileşikler olarak düşünülebilir, böylece her iki atom da soygazla elektronik konfigürasyona kavuşurlar. Atomik orbitallerin çakışmasıyla kovalent bağlarla bağlanabilirler ya da aralarında pozitif yüklü bir tür ile negatif yüklü bir tür arasındaki çekim kuvveti olan iyonik bağlar oluşturabilirler. Diatomlar arasında kovalent bağlar için örnekler arasında CO, NO vs bulunur ve HCl, iyonik çekim özelliğine sahip bir tür olarak düşünülebilir. Bununla birlikte, H + ve Cl- arasındaki cazibe kuvveti çok güçlü olmadığı için, başka bir tanımlanmış konu olan iyonik bağlar için çok iyi bir örnek değildir.
Monatomik ve Diatomik arasındaki fark nedir?
• Monatomik türlerin bir atomu, diatomik türlerin iki atomu vardır.
• Monatomik türler genellikle kararlı değildir, ancak diatomik türler genellikle kararlıdır.
• Soy gazlar sadece monatomiktir ve diatomik formda bulunmazlar.
• Kimyasal bağlar diatomik türler arasında bulunurken monatomik türlerde bağ yoktur.
Görüntüler Nezaket:
DePiep'in Oksijen elektron konfigürasyonu (CC BY-SA 3. 0)


