Varlık ve Valans Elektronları Arasındaki Fark | Valans ve Valans Elektronları
Anahtar Farklılıklar - Valans ve Valans Elektronları
Valans elektronları ve değerlik elektronları birbiriyle ilişkili terimlerdir ve değerlik ve değerlik elektronları arasındaki anahtar farkı en iyi tanımlamalarında açıklanmaktadır; değerli elektron , elementinin en dış kabuğundaki elektronlardır, buna karşın değerlik elektronları , en yakın soygaz konfigürasyonunu elde etmek için kabul veya kaldırılması gereken elektronların sayısıdır. Genellikle kimyasal bağlar oluşturan en dış kabuktaki elektronlardır. Bazı atomlarda, valans elektronlarının sayısı, valans elektronlarının sayısına eşittir. V
Aletler Elektronlar Nedir? Bir atomun en dış kabuğundaki elektronların sayısına "değerlik elektronları" denir. Bu nedenle, bir atomun en dış kabuğu "değerlik kabuğu" olarak adlandırılır. Çoğu zaman, bunlar kimyasal bağda yer alan elektronlardır. Elemanlar katyonlar oluşturduğunda, elektronları değerlik kabuğundan çıkarırlar. Bir elementin valans elektronlarının sayısı periyodik tablodaki grubu belirler.
Valans Elektronları nedir?

3'ten büyük ->
- diff Madde Tablo ortasından önce orta ->
Ana grup elemanlarının valansı Metal elementler için
|
Valans Elektronları:
Bir atomun en dış kabuğundaki elektronlara "değerlik elektronları" denir. "S" ve "p" grup elementleri için valens elektronlarının sayısı grup numaralarına eşittir.
Örnek Geçici Elektronlar:
En yakın soygazın elektron konfigürasyonuna erişmek için kabul veya kaldırılması gereken elektronların sayısına "değerlik elektronları" veya bir atomun "değerlik" adı verilir.
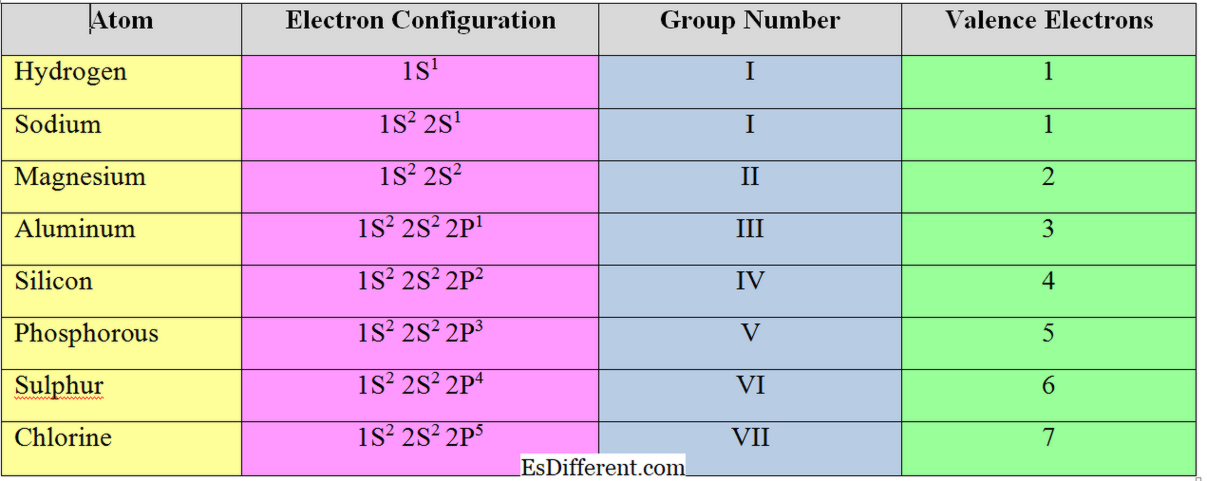
Genel olarak, metal elementler (grup I, II ve III'deki elementler için), valens elektronlarının sayısı, valans elektronlarının sayısına eşittir; onlar sekizlik yapıyı elde etmek için valans kabuğundaki elektronları çıkarırlar. Ancak, metal olmayan elementler, en yakın asal gazın elektron konfigürasyonunu elde etmek için elektronları kabul eder. Bu nedenle, metal olmayan elementlerin valansı, 8'den toplam değerlik elektronları çıkarılarak hesaplanır. Klor için, değerlik elektronlarının sayısı = 8-7 = 1
Varlık ve Değerlik Elektronlarının Nitelikleri
Valensiya ve Grup VIII elementlerinin valans elektronları
Değerlik elektronları:

Grup VIII elementleri asal gazlardır ve kimyasal olarak kararlıdırlar. Dış kabuğu tamamlanmış ve en dış kabuğunda sekiz elektron bulunmaktadır (Helyum-He hariç); böylece VIII. grup elektronların sekiz değerlik elektronu vardır.
Aktif Elektronlar:
Aktiflik, diğer elementler veya moleküllerle bağ oluşturma kabiliyetinin bir ölçüsüdür. Asal gazlar, sekiz kuralı elde etmek için elektronları kabul etmez veya kaldırmaz çünkü son kabuğu zaten tamamlarlar. Dolayısıyla VII. Elementlerin değerlikleri sıfıra eşittir. Görüntü Nezami:
"Elektronik kutu 010 Neon - etiket yok": Kullanıcı: Pumbaa (orijinal çalışma: Kullanıcı: Greg Robson) - // commons. wikimedia. org / wiki / Kategori: Electron_shell_diagrams (etiketli versiyona karşılık gelen). (CC BY-SA 2. 0 uk) Commons aracılığıyla




