1S ve 2s Orbital Arasındaki Fark | 1s vs 2s Orbital
Anahtar Farkı - 1s 2s Orbital
Atom, maddenin en küçük birimi. Başka bir deyişle, tüm maddeler atomlardan yapılır. Bir atom, esasen protonlar, elektronlar ve nötronlar olmak üzere atom altı parçacıklardan oluşur. Protonlar ve elektronlar atomun merkezinde bulunan çekirdeği oluştururlar. Ancak elektronlar atomun çekirdeğinin dışında bulunan yörüngelerde (veya enerji seviyelerinde) konumlandırılırlar. Ayrıca, orbitallerin, bir atomun en olası yerini açıklamak için kullanılan varsayımsal kavramlar olduğuna dikkat etmek de önemlidir. Çekirdeği çevreleyen çeşitli orbitaller var. S, p, d, f, vb. Gibi alt-orbitaller de vardır. S alt-yörüngesi, bir 3B yapı olarak düşünüldüğünde küresel şeklidir. Orbital, çekirdeğin etrafında bir elektron bulma olasılığının en yüksekine sahiptir. Bir alt yörünge yine enerji seviyelerine göre 1s, 2s, 3s, vb. Olarak numaralandırılır. 1s ve 2s orbitalleri arasındaki en önemli fark her orbitalin enerjisidir. 1s orbitalinin 2s yörüngesinden daha düşük bir enerjisi vardır.
İÇİNDEKİLER
1. Genel ve Anahtar Farkı
2. 1s Orbital nedir
3. 2s Orbital nedir
4. Yan yana karşılaştırma - 1s vs 2s Orbital
5. Özet
1s Orbital Nedir?
1s orbital, çekirdeğe en yakın yörüngedir. Diğer orbitaller arasında en düşük enerjiye sahiptir. Ayrıca en küçük küresel şeklidir. Bu nedenle, yörüngesinin yarıçapı küçüktür. Orbitalde sadece 2 elektron olabilir. Elektron konfigürasyonu, s orbitalinde sadece bir elektron varsa, 1s 1 olarak yazılabilir. Fakat eğer bir çift elektron varsa, 1s 2 olarak yazılabilir. Daha sonra, s orbitalindeki iki elektron, iki elektronun aynı elektrik yükleri nedeniyle oluşan itme nedeniyle ters yönde hareket eder. Eşleşmeyen bir elektron olduğunda paramanyetik denir. Bunun nedeni, bir mıknatıs tarafından çekilebilmesidir. Fakat eğer yörünge doluysa ve bir çift elektron varsa, elektronlar bir mıknatıs tarafından çekilemez; Bu diamagnetic olarak bilinir.
2s Orbital Nedir?
2s orbitali 1s yörüngesinden büyüktür. Bu nedenle, yarıçapı 1s yörüngesinden daha büyüktür. 1s yörüngesinden sonra çekirdeğin bir sonraki dolap yörüngesidir. Enerjisi 1s yörüngesinden daha yüksek ancak bir atomdaki diğer orbitallerden daha düşük. 2s orbitali sadece bir veya iki elektron ile doldurulabilir. Fakat 2s orbitali yalnızca 1s yörüngesinin tamamlanmasından sonra elektronlarla doldurulur.Buna alt yörüngelere elektron doldurma sırasını belirten Aufbau prensibi denir.
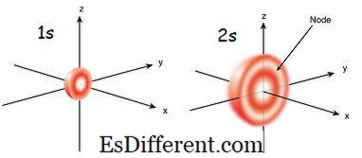
Şekil 01: 1s ve 2s Orbital
1s ve 2s Orbital arasındaki fark nedir?
- Table'den önce Orta Makale ->
1s-2s Orbital |
|
| 1s orbital çekirdeğin en yakın yörüngesidir. | 2s orbital çekirdeğin ikinci en yakın yörüngesidir. |
| Enerji Seviyesi | |
| 1s orbitalinin enerjisi 2s orbitalinin enerjisinden daha yüksektir. | 2 sn'de göreceli olarak daha düşük enerji var. |
| Yörünge Radyusu | |
| Yörüngesinin yarıçapı daha küçüktür. | 2s yörüngesinin yarıçapı oldukça fazladır. |
| Orbital | |
| Oranlı'nın boyutu en küçük küresel şekle sahiptir. | 2s orbitali 1s yörüngesinden büyüktür. |
| Elektron Dolum | |
| İlk olarak 1s yörüngesinde elektronlar doldurulur. | 2s orbitali, 1. yörüngedeki elektronların tamamlanmasından sonra doldurulur. |
Özet - 1s vs 2s Orbital
Atom, merkezde, farklı enerji seviyelerindeki çeşitli şekillerde orbitallerle çevrili bir çekirdek içeren bir 3B yapıdır. Bu orbitaller, hafif enerji farklılıklarına göre tekrar alt-orbitallere ayrılmıştır. Bir atomun büyük bir atom altı parçacığı olan elektronlar bu enerji seviyelerinde bulunurlar. 1s ve 2s alt-orbitalleri çekirdeğin en yakınındadır. 1s ve 2s orbitalleri arasındaki en büyük fark, enerji seviyelerinin farkıdır; 2s orbital, 1s orbitalinden daha yüksek bir enerji seviyesidir.
Referans:
1. Libretexts. "Atomik Orbitaller. "Kimya LibreTexts. Libretexts, 03 Kasım 2015. Web. 26 Mayıs 2017.
2. Atomlar, Elektronlar ve Orbitaller. N. s., n. d. Ağ. 26 Mayıs 2017.
Resim Nezami:
1. "S orbitalleri" (kırpılmış) CK-12 Vakfı - Dosyası: Lise Kimyası. pdf, sayfa 265 (CC BY-SA 3. 0) aracılığıyla Commons Wikimedia




