S ve P Blok Elemanları Arasındaki Fark | S vs P Blok Elemanları
Anahtar Difference - S vs P Blok Elemanları
s ve p blok elemanları arasındaki anahtar farkı , elektronik konfigürasyonlarını kullanarak en iyi açıklanabilir. S blok elemanlarında, son elektron s alt kabına doluyor ve p blok elemanlarında, son elektron p alt kabuğuna dolduruyor. İyon oluşturduklarında; s blok elemanları, elektronlarını en dıştaki alt tabakadan kolayca çıkarırken, p blok elemanları p alt kabuğuna elektron kabul eder veya p-alt kabuğunda elektronları çıkarır. P-grubundaki bazı elementler pozitif iyonlar oluşturarak elektronları en dışındaki p-alt kabuğundan çıkarırlar ve bazı elementler (en elektronegatif elementler) diğerlerinden bir elektron kabul eden negatif iyonlar oluştururlar. Kimyasal özellikleri göz önüne aldığınızda, s ve p blok elemanları arasında önemli bir fark vardır; Bu temelde elektron konfigürasyonundan kaynaklanmaktadır.
S-blok Elemanları Nedir?
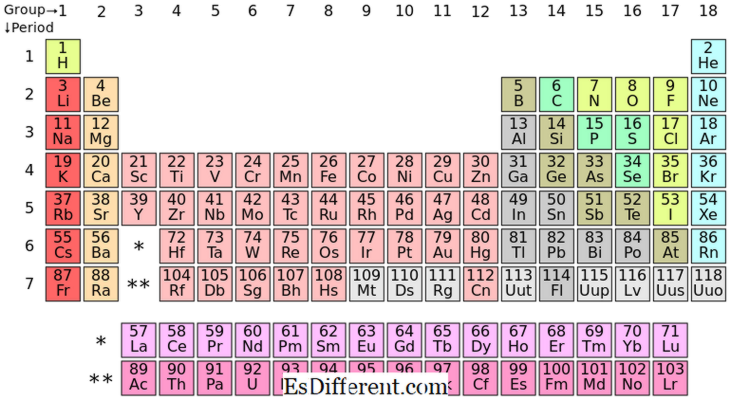
S-blok elementleri, periyodik tabloda I ve II. Gruptaki kimyasal elementlerdir. Subselller sadece iki elektron barındırabileceğinden, bu elementlerin en dış kabuğunda genellikle bir (grup I) veya iki (grup II) elektron bulunur. Grup I ve II'deki unsurlar tabloda yukarıda gösterilmiştir.
- Tablo 9- II 2| Be | 3 | |
| Na | Mg | 4 |
| K | Ca | 5 |
| Rb | Sr | 6 |
| Cs | Ba | 7 |
| Cu | Ra | - |
| IA | Alkali metaller | II A |
| S-bloğundaki tüm elementler pozitif iyonlar oluştururlar ve çok reaktiftirler. | S-bloğu Elemanlarının Periyodik Tablo'da yerleştirilmesi |
| |
P-blok Elemanları Nedir? |
P-blok elemanları, son elektronları p alt kabuğuna dolduran elementlerdir. Üç p-orbitali vardır; her yörüngede iki elektron bulunur ve toplamda altı p-elektron oluşur. Bu nedenle, p-bloğu elementleri en dış kabuğunda bir ila altı p-elektrona sahiptir. P-bloğu hem metalleri hem de metal olmayanları içerir; Buna ek olarak bazı metaloidler de vardır.
13
1415
16
| 17 | 18 | 2 | B | C | , N | |
| O | K Ne | 3 | , Al | Si | p | S |
| Cı | Ar ' 4 | Ga | Ge | de | Se | Br |
| Kr | 5 | de | , Sn | Sb | Te | ı |
| Xe'nin | 6 | , Tl | Pb Bi | Po | At | Rn |
| S ve P blok elemanları arasındaki fark nedir? | Ortak Elektron Konfigürasyonu: | S-blok Elemanlar: | S-blok elemanları, [soygaz] ns | 1 | (grup I elementler için) ve [soygaz] ns | 2 |
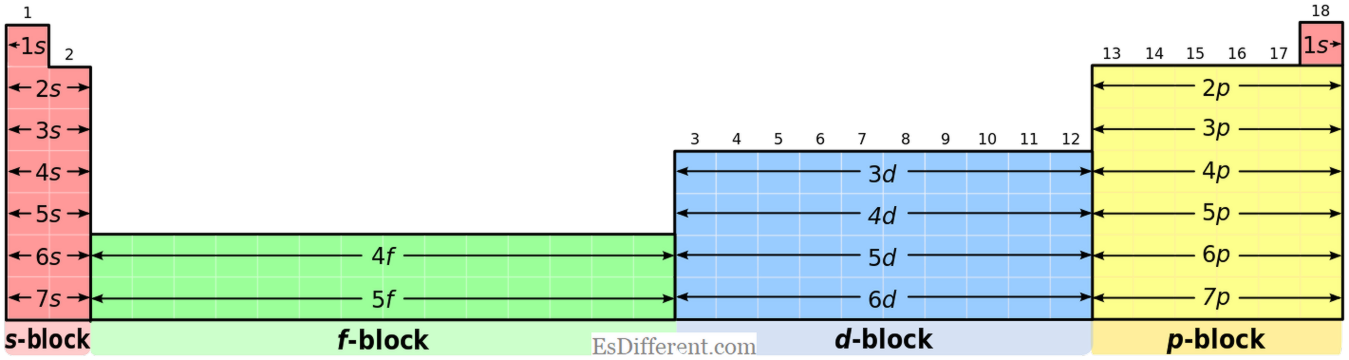
(II. grup elementler için).
P-blok Elemanları:
P-blok elementleri, [soygaz] ns 2 np 1-6 ortak elektron konfigürasyonuna sahiptir. Fakat helyum 1s 2
konfigürasyonuna sahiptir; Bu özel bir durum. Oksidasyon Durumları: S-blok Elemanları: S-blok elementleri, p-blok elementleri gibi çoklu oksidasyon durumları göstermez. Örneğin, I elementleri +1 oksidasyon durumu gösterirken, II. Elementler +2 oksidasyon durumu gösterirler. P-blok Elemanları: S-blok elemanlarından farklı olarak, p-blok elemanları, periyodik tablodaki ilgili grupları için ortak bir oksidasyon durumuna ve iyonun kararlılığına bağlı olarak diğer bazı ilave oksidasyon durumlarına sahiptir. Grup 13
14
15 16
17 18
| Genel elektron konfigürasyonu | ns | 2 | np | 1 | ns | 2 |
| np | 2 ns 2 np | 3 ns 2 NP | 4 | n n 2 n | 6 1 st | C N O F |
| He Genel oksidasyon sayısı +3 | +4 | +5 | -2 | -1 | 0 | Diğer oksidasyon durumları |
| +1 | +2, -4 | +3, -3 | +4, +2, | +3, +5, +9, 1, +7 | - | Özellikler: |
| S-blok Elemanları: | Genel olarak, tüm blok elemanları metallerdir. Parlak, iyi elektrik ve ısı iletkenleri ve valans kabuğundan elektronları çıkarmak kolaydır. Periyodik tablodaki en reaktif elementlerdir. | P-blok Elemanları: | P-blok elemanlarının çoğu metal dışıdır. Düşük kaynama noktaları, zayıf iletkenler ve en dıştaki kabuktan elektronları çıkarmak zordur. Bunun yerine elektron kazanırlar. Metal olmayan metallerin bazıları oda sıcaklığında katı maddeler (C, P, S, Se) olup bazıları gazlardır (Oksijen, Azot). Brom bir metal değildir ve oda sıcaklığında sıvıdır. | Buna ek olarak, p-bloğu bazı metalik öğeler içerir; alüminyum (Al), galyum (Ga), indiyum (In), kalay (Sn), tali (Tl), kurşun (Pb) ve bizmut (Bi). | Resim Nezami: | 1. DePiep [CC BY-SA 3. 0] tarafından Commons |
yoluyla "Periyodik tablo (poliatomik)". "Periyodik tablo blokları spdf (32 sütun)" kullanıcı tarafından: DePiep [CC BY-SA 3. 0] Commons aracılığıyla


