Hidroksil ve Hidroksit Arasındaki Fark | Hidroksil vs Hidroksit
Anahtar Difference - Hidroksil vs Hidroksit
İki terim hidroksil ve hidroksit, birbirine benzeyen iki oksijen (O = 16) ve Hidrojen (H = 1). Hidroksit, tek bir yük ile negatif bir iyon olup hidroksil, serbest formunda bulunmaz; başka bir molekül veya iyonun bir parçasıdır. Hidroksit iyonları, bir molekülde hidroksil grubundan daha reaktiftir. Bu, hidroksil ve hidroksit arasındaki en önemli farktır.
Hidroksil Nedir?
Hidroksil nötr bir bileşiktir ve hidroksit iyonunun karşılık gelen elektriksel olarak nötr bileşendir. Serbest hali olan hidroksil (• HO) bir radikaldir ve kovalent olarak diğer moleküllere bağlandığında hidroksil (-OH) grubu olarak adlandırılır. Hidroksil grupları nükleofiller gibi davranabilir ve hidroksil radikali organik kimyada bir katalizör olarak kullanılır. Hidroksil grupları, diğer nükleofiller kadar oldukça reaktif değildir. Bununla birlikte, 'hidrojen bağları' olarak adlandırılan güçlü intramoleküler güçlerin oluşumundaki kolaylaştırıcılardır.

Hidroksit Nedir?
Hidroksit, bir oksijen atomu ve bir hidrojen atomu içeren iki atomlu bir anyondur. Oksijen ve hidrojen atomu arasındaki bağ kovalentdir ve kimyasal formülü OH - dır. Suyun kendinden iyonlaşması hidroksil iyonları üretir ve bu nedenle hidroksil iyonları suyun doğal bir parçasıdır. Hidroksit iyonları bir baz, ligand, nükleofil ve kimyasal tepkimelerde bir katalizör olarak kullanılır. Buna ek olarak, hidrojen iyonları metal katyonlarla tuz oluşturur ve çoğu sulu solüsyonlarda ayrışarak çözülmüş hidroksit iyonlarını serbest bırakır. Birçok inorganik kimyasal madde kendi adına "hidroksit" terimini içerir, ancak iyonik değildirler ve hidroksil grupları içeren kovalent bileşiklerdir.

Hidroksil ve Hidroksit arasındaki fark nedir?
Yapı:
Hidroksil: Hidroksil, radikal ve kovalent bağlı biçimde iki şekilde bulunabilen, elektriksel olarak nötr bir bileşiktir.

Hidroksil radikali Kovalent olarak bir moleküle bağlandığında
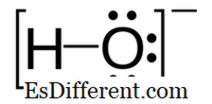
Hidroksit: Hidroksit negatif yüklü bir iyon, negatif yük ise oksijen atomu üzerindedir.
Hidroksil: Hidroksil grupları birçok organik bileşikte bulunur; alkoller, karboksilik asitler ve şeker içeren hidroksil grupları. Su, alkoller ve karboksilik asitler gibi hidroksil grupları içeren bileşikler kolaylıkla deprotonize edilebilir.Buna ek olarak, bu hidroksil grupları hidrojen bağı oluşumuna girmektedir. Hidrojen bağları, moleküllerin birbirine yapışmasına yardımcı olur ve bu, daha yüksek kaynama ve erime noktalarına sahiptir. Genel olarak, organik bileşikler az suda çözünebilir; bu moleküller iki veya daha fazla hidroksil grubu içerdikleri zaman hafifçe suda çözünebilir hale gelirler.
Hidroksit: Hidroksit içeren kimyasalların çoğunun aşındırıcı olduğu kabul edilir ve bazıları çok zararlıdır. Bu kimyasallar su içinde eritildiğinde, hidroksit iyonu inanılmaz derecede güçlü bir baz görevi görür. Hidroksit iyonu negatif bir yük taşıdığından genellikle pozitif yüklü iyonlara bağlanır.
Su molekülünde hidroksit grupları içeren bazı iyonik bileşikler suda gerçekten iyi çözünür; sodyum hidroksit (NaOH) ve potasyum hidroksit (KOH) gibi aşındırıcı bazlar örnek alınabilir. Bununla birlikte, iyonik bileşikler içeren bazı başka hidroksit suda hafifçe çözünmez; örnekler, bakır (II) hidroksit [Cu (OH) - parlak mavi renkli] ve demir (II) hidroksit [Fe (OH) - kahverengi] şeklindedir. Reaktiflik: Hidroksil
: Hidroksil grupları, hidroksit grubuna kıyasla daha az reaktiftir. Fakat, hidroksil grupları hidrojen bağları oluşturur ve molekülleri suda daha çözünür hale getirmeye katkıda bulunur.
Bununla birlikte, hidroksil radikaller organik kimyasal reaksiyonlarda oldukça reaktif ve çok yararlıdır. Hidroksit:
Hidroksit (OH
- ) grubu, Organik kimyada güçlü bir nükleofil olarak düşünülür. Kaynaklar: Martin. Chaplin @ BTInternet. com, M.C. (n.d.). Hidroksit iyonları. 28 Aralık 2016'da buradan alındı, Hidroksit Ion: Tanım ve Formül - Video ve Ders Transkripti. (n.d.). 28 Aralık 2016'da buradan alındı. Hidroksit. (n.d.). 28 Aralık 2016, burada Hidroksi grubundan alındı. (n.d.). 28 Aralık 2016, burada itibaren alındı Hidroksi Grubu: Tanımı, Yapısı ve Formül. (n.d.). 28 Aralık 2016'da buradan alındı, H. (2014). Hidroksil Grubu Nedir? 28 Aralık 2016'dan itibaren buradan alındı